


La colonisation de
nouvelles espèces dans une région du monde est un phénomène
naturel, qui peut être fortement amplifié par l’action de
l’homme.
En effet, l’introduction
de nouvelles espèces fut favorisée à la fin du XIXeme
siècle par la Société Zoologique Nationale d’Acclimatation
qui récompensait toute personne réalisant l’acclimatation
de nouvelles espèces animales ou végétales.
Dans le domaine de l’ichtyologie, la découverte de la reproduction artificielle de la truite par Remy et Gehin en 1843 a été à l’origine de nombreuse tentatives d’acclimatations de nouvelles espèces de poissons.
Ces introductions de poissons n’ont pas été sans conséquences pour les milieux concernés, le poisson-chat (Ictalurus melas) est considéré comme nuisible, l’introduction du Black-bass (Microptenus salmoïde) au Portugal à provoqué la disparition de l’ichtyofaune endémique de petite taille dans le sud du pays.
Le Silure (Silurus glanis) est aujourd’hui un sujet sur lequel beaucoup de choses ont été dites, pas toujours basées sur des données scientifiques, il est donc nécessaire de faire le point sur son rôle et sa place « écologique ».
Nous examinerons d’abord les principaux éléments de la biologie de ce poisson et l’évolution de sa biogéographie.
Les conséquences pour les biocénoses impliquées peuvent être multiples, nous en examinerons les différents aspects.
L’aspect socio-économique
n’étant pas négligeable, il est intéressant
d’en dégager les points les plus importants.
I-1- Position systématique
Selon Berg (1964) la classification zoologique du Silure glane est :
- Superclasse des Poissons
- Classe des Ostéichtyens
- Sous-classe des Actinoptériygiens
- Super-ordre des Téléostéens
- Ordre des Cypriniformes
- Sous ordres des Siluroides
- Famille des Siluridés
- Genre Silurus
- Espèce glanis (Linné)
D’après Spillman (1961) et Berg (1964), le corps du Silure
est allongé, à section sphérique, mais comprimé
latéralement à partir de l’anus. La peau est nue, dépourvue
d’écailles. La tête est forte et large, elle est pourvue de
trois paires de barbillons : une paire très développées
sur la mâchoire supérieure, et deux paires sur la mâchoire
inférieure. Les barbillons mandibulaires antérieurs sont
plus courts que les postérieurs. Les maxillaires sont très
rudimentaires. Les dents sont présentes sur les intermaxilaires,
le mandibule, le vomer et les pharyngiens. Les dents palatines sont absentes.
Les dents vomériennes sont en bande continue, avec seulement une
encoche postero-médiane. Les pièces operculaires sont recouvertes
par la peau, et il n’y a pas de préopercule. Les cinq premières
vertèbres sont soudées .
La nageoire adipeuse est absente. La vessie natatoire est libre
et reliée à l’oreille interne par les osselets de Weber (trois
petits os de chaque coté du crâne sous la colonne vertébrale),
ceci permet au Silure de capter une large gamme de vibrations. La nageoire
dorsale, située en avant de l’aplomb des pelviennes, est très
petite et sans rayons épineux. La nageoire anale est très
longue, et se distingue de la caudale que par une légère
échancrure. Les nageoires pectorales ont un premier rayon ossifié
et dur.
Comme le montre la figure 1 la coloration est variable, le ton
va du vert olive au gris noirâtre, marbré sur les flans et
blanc sur le ventre.
Le Silure glane est une espèce d’eau chaude puisque la
température optimum de croissance est de 28 à 30°C, avec
un début d’alimentation vers 14°C.
Ce point est important car c’est un des facteurs qui va déterminer
sa distribution géographique, en effet comme cela est détaillé
dans le chapitre concernant sa répartition il occupe la partie sud
de l’Europe.
I-3- Principaux éléments de biologie
I-3-1- La reproduction du silure
Le Silure a un cycle de reproduction annuel. Tout d’abord vers
fin mars début avril, lorsque l’eau a une température comprise
entre 8 et 10°C, il va effectuer une migration de préfraie,
depuis la zone lotique qu’il occupe préférentiellement jusqu’à
la zone lentique près des berges (Berg 1964, Schikhshabekov 1979).
La période de fraie varie selon les lieux : elle se situe
entre fin avril et fin juillet et dure de un mois et demi à deux
mois et demi (Mohr 1957, Berg 1964, Hochman 1967, Abdullayev et coll 1978,
Schikhshabekov 1979).
Il semble que se soit la température de l’eau qui conditionne
la date de début de la fraie, cette température doit être
au minimum de 18 à 20°C (Mohr 1957) et même de 20 à
22°C d’après Schikhshabekov, Hochman (1979) précise même
qu’une chute de pression barométrique déclenche l’activité
reproductive.
Dans les cours d’eau la fraie a lieu le long des rives,
là où les racines des arbres fournissent des abris et des
supports pour les œufs (Horvath et coll 1984), dans les déltas des
grands fleuves, la fraie a lieu dans les plaines d’inondation recouvertes
de massettes (Berg 1964).
Cependant, si les conditions ne sont pas favorables, le mâle
construit un nid dans la vase parmi les végétaux (Wilcolskyg
1969).
Au moment de la fraie, il y a compétition pour les frayères
et les mâles développent une grande agressivité, les
blessures peuvent être importantes.
La fraie a généralement lieu la nuit, et s’accompagne
d’une parade nuptiale durant laquelle, les ovules émis par la femelle
sont immédiatement fertilisés par les mâles, les chapelets
d’œufs sont recouverts d’une couche épaisse de gel qui les rend
visqueux, et leur permet d’adhérer aux obstacles (racines).
Le mâle reste près du nid pendant l’incubation des
œufs, et les ventile par des mouvements de la queue afin d’assurer une
bonne oxygénation (Horvalth et coll 1984).
L’embryogenèse est assez courte, de 60 à 70 degrès/jours
(Horvalth 1977) et les alevins commencent à nager 3 à 4 jours
après l’éclosion, le mâle abandonne alors le nid.
Les alevins sont peu mobiles et ont tendance à rester
groupés (Berg 1964, Horvalth et coll 1984).
La fertilité relative est très variable selon les
auteurs, elle varie de 7000 à 42000 œufs par kilogramme de poisson
(Mohr 1957), elle varie également avec la provenance géographique,
la taille du poisson, l’approvisionnement en nourriture et la température
de l’eau.
Le diamètre des œufs varie de 1,94 à 3,0 mm (Mohr
1957, Hochman 1967).
La taille du poisson a une grande importance pour l’âge
de la maturité, ainsi un taux de croissance faible induit un retard
de l’âge de la maturité sexuelle, en général
les mâles arrivent à maturité dans leur 3eme ou 4eme
année (Berg 1964, Hochman 1967), les femelles plus tardives sont
matures dans leur 5eme ou 6eme année.
I-3-2-1- Comportement alimentaire du Silure glane
La plupart des auteurs remarquent que le Silure est un poisson
de fond ayant une activité essentiellement nocturne. Il est décrit
comme un poisson prédateur, vivant dans les eaux tranquilles, de
profondeur importante et aux fonds vaseux (Mohr 1957, Likolshiy 1955).
Le Silure possède tout l’équipement sensoriel pour
une prise de nourriture nocturne, ceci a été démontré
avec les expériences de Todd 1971, Peritsyma 1978, Malyukina
et Martem’ganov 1982, en effet ce poisson (qui appartient aux Ostariofisaire)
possède entre la vessie natatoire et l’oreille interne une série
de petit os, les osselets de Weber, qui relie ces deux organes permettant
de percevoir des vibrations acoustiques, très utiles dans la recherche
de nourriture.
D’autre part ses barbillons et sa ligne latérale joue
un rôle prépondérant dans la localisation des proies.
I-3-2-2- Le régime alimentaire
- Alimentation des alevins et des juvéniles
Tableaux I récapitulatifs montrant la composition du régime
alimentaire d’alevins de silures :
(simplifié par TAMAS, 1970 in PINTER 1977)
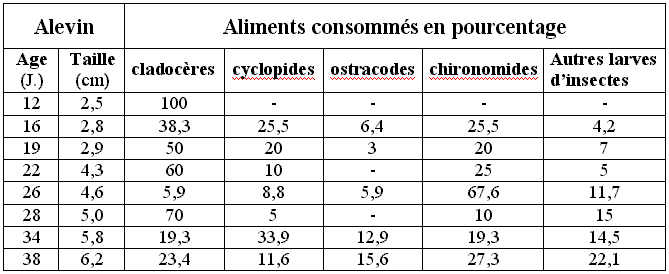
Comme le montre le tableau I, il est possible de remarquer que
le régime alimentaire des alevins est composé en grande partie
de zooplancton et d’invertébrés benthiques, cette alimentation
n’est pas spécifique au Silure glane mais se retrouve chez la plupart
des alevins d’eau douce.
C’est lors de sa croissance que les Silures vont acquérir
des composantes spécifiques dans leur régime alimentaire.
Ainsi selon Tleouov et Gouseva (1977) puis Stolyarov (1985), le régime alimentaire des alevins et des juvéniles est le suivant :
- Pour les individus ayant une de taille comprise entre 1,25 et 2,11
cm, l’alimentation est essentiellement composée d’organismes benthiques
(larves de chironomes) ainsi que d’organismes de pleines eaux (daphnies),
mais également de débris végétaux et de larves
de poissons.
- A partir de 3 cm jusqu’à 8,4 cm l’alimentation est similaire
mais comporte en plus des poissons.
- De 8,4 à 13,3 cm, 85% des proies sont des poissons (chabots,
gardons, barbeaux).
- A partir de la 2eme année le Silure est presque totalement
ichtyophage ( 95% des proies), dont notamment : chabots, carpes, ablettes,
barbeaux.
C’est donc le caractère ichtyophage qui va prédominer.
- Alimentation des adultes
Le Silure est un prédateur principalement ichtyophage : jusqu’à 98% de la masse totale des proies (Stolyarov 1985); le spectre des proies est très large : brèmes, carpes, sandres, gardons, rotengles, tanches, aspes, brochets, silures, perches (Stolyarov 1985, Orlova et Popava 1976).
Tableau II indiquant les espèces consommées par le Silure glane, établit à partir d’examen de contenus stomacaux de silure adultes ( PINTER, 1976 ) :

Comme le montre le tableau II les espèces consommées autres
que les poissons appartiennent à divers taxons:
Mollusques, Insectes, Amphibiens, Crustacés (écrevisses),
Mammifères (rats),
Oiseaux.
La très large gamme de proies consommées par le Silure
montre bien le caractère opportuniste de ce poisson, ainsi dans
les fleuves où les muges (Mugil cephalus) sont présents en
grande quantité (Rhône, Loire), ils seront recherchés
activement (Cloux, Duchesne, Fromentin 1996).
II-1- Le Silure glane dans le monde
La répartition du Silure glane est comme nous allons le voir
dans ce chapitre un exemple très intéressant de biogéographie,
nous allons tout d’abord commencer par l’étude de sa répartition
au niveau mondial.

carte de répartition du Silure glane dans le monde d’après Planche (1986) et Gérard (1991)
Cette carte nous montre que l’aire de répartition du Silure
glane a une tendance à l’expansion vers l’ouest, de plus nous
remarquons que ce sont les grands bassin fluviaux qui sont colonisé
préférentiellement : en France le bassin du Rhône,
de la Loire, de la Seine et de la Garonne; en Italie le bassin du Pô;
en Espagne celui du Rio Ebro.
Avant de traiter le problème de la colonisation récente
de la France, nous allons nous intéresser à l’évolution
des populations de Silures à travers les époques géologiques.
Les données paléontologiques nous montrent que
le Silure glane était présent en France au Pliocène
de 2 à 5 millions d’années, au Serat d’en Vacquer, près
de Perpignan (Depéret 1985).
La régression de l’aire de répartition est probablement
due aux grandes glaciations du Pléistocène (de 10 milles
à 2 millions d’années), provoquant
l’avancée des glaciers du nord de l’Europe et des Alpes dans
un axe nord-est sud-ouest , bouleversant la géographie et les climats.
La présence physique des glaciers associée à
une baisse générale de la température, a repoussé
l’ensemble des espèces de poissons vers le sud.
En ce qui concerne le Silure, il a certainement trouvé
refuge à l’aval du bassin du Danube pour les populations d’Europe
centrale.
Les populations orientales et occidentales ont rencontrées
une barrière physique infranchissable causant leur disparition :
les Pyrénées, la mer Méditerranée et les Alpes
à l’ouest ; la mer Noire, le Caucase et le mer Caspienne à
l’est.
La baisse de température
a dû jouer un rôle prépondérant (Brana et Rigaud
1997).
II-2- Introduction en France
II-2-1- Historique et modalités
Les informations concernant la recolonisation récente du Silure en France sont relativement contradictoires. Cependant nous pouvons distinguer quelques grandes phases :
- La fin du XIXeme siècle et la première moitié
du XXeme siècle sont caractérisées par un ensemble
d’acclimatations non réussies ; le Silure était présent
dans le Bas-Rhin (Roule 1925-1935, Bertin 1942-1949, De Boisset 1947, Spillman
1961).
De La Blanchére (1868) relate une dizaine de silures relâchés
dans un
bassin du canal du Rhône au Rhin, puis repêchés
l’année suivante dans le
Doubs.
Il faut noter que l’ensemble de la recolonisation du Silure
est due à l’homme, favorisée par le développement
de son élevage en France, à l’aide de nombreux déversements
volontaires, le plus souvent anonymes, effectués dans tous les grands
bassins fluviaux français (Barbier 1995).
- En 1966, 29 petits silures en provenance du Danube furent introduits
dans
un plan d’eau de la Dombes dans l’Ain.
Une des introductions qui semble avoir été fondamentale,
fut celle d’un propriétaire d’étang en 1968, qui introduisit
20 sujets de 300 grammes dans la Sanne morte, affluent de la Seille, elle
même affluent de la Saône, ceci est visible sur la figure 4-1.
En effet, cet introduction est la seule connue dont les effets
ont été observés dans des zones proches du déversement
; avec notamment la capture au carrelet d’un poisson de 25 kg dans la Sane
Vive le 29 juin 1977.
Il a été possible de suivre la progression de la colonisation du Silure dans la Seille, puis dans la Saône.
- De même dans le bassin de la Loire (figure 4-2 et 4-3), des
silures élevés dans un étang près de Neuvy-Granchamp
se sont déversés dans l’étang jouxtant, suite à
une rupture de digue en 1974.
Les jeunes alevins passant à travers les grilles ont ensuite
gagné le Blandenan petit affluent de la Loire (Allardi communication
personnelle).
- Plus récemment le bassin Garonne-Dordogne a subit des introductions
de
silures, les premiers sujets ont été recensés
en 1992, depuis la population est en croissance, (voir figure 4-4) (Galiay
1997).
- La Seine est également en cours de colonisation avec semble-t-il
une population importante sur Paris, les pêcheurs signalent de nombreuses
captures de poissons de toutes tailles.
II-2-2- Evolution des populations en France

Figure 4 : cartes de la répartition du Silure glane en
France
(d’après :- « L’atlas préliminaire des poissons
d’eau douce de France »
(CSP-CEMAGREF) Allardi et Keith - «
Les poissons d’eau douce des rivières de France », Billard
1987
- Diverses données attestant de la
présence du Silure )
II-2-3- Vitesse de la colonisation
L’exemple du bassin Garonne-Dordogne est très intéressant,
car la colonisation est très récente et il y a un suivi des
populations très précis, grâce aux ascenseurs à
poissons mis en place au niveau d’aménagements hydroélectriques
permettant aux poissons migrateurs de franchir ces ouvrages : Tuilière,
Golfech, Le Bazacle

Figure 5 : passage des Silures aux stations de contrôle du
bassin Garonne-Dordogne
(Galilay 1997).
Ces données nous montrent que lorsque le Silure est présent
dans un bassin qui lui est favorable, il est capable en quelques années
d’arriver à des populations non négligeables bien que les
populations de silures sont encore très récentes.
L’augmentation peut être importante, en effet certaine
station de contrôle montre une augmentation des passages de silures
jusqu'à plus de 600% d’une année à l’autre (Golfesh).
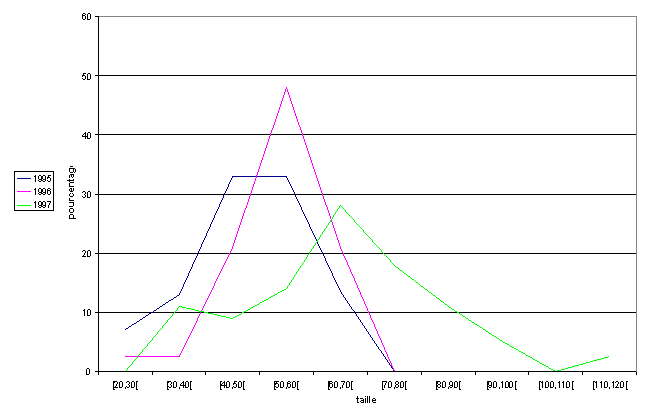
Figure 6 : histogramme montrant l’evolution de la taille des silures
à la ststion de
Tuillere en 1995, 1996 et 1997 (Galiay 1997).
Nous observons avec la figure 6 une augmentation de la taille
moyenne des poissons, ceci est cohérent avec le fait que dans
le bassin Garonne-Dordogne les populations de silures sont encore
très récentes.
Il est intéressant de noter que la reproduction du silure semble
bien s’effectuer, en effet chaque année de nouveaux individus de
la classe d’âge la plus jeune sont comptabilises.
Dans les autres cours d’eaux les observations sont de type qualitatif et non quantitatif, car il n’y a pas de suivis précis des populations de Silures. En effet, nous ne possédons pas de données précises sur la densité de Silures, ainsi que son importance par rapport aux autres espèces dans tous les cours d’eaux, mais des relevés de sa présence effectués par le Conseil Supérieur de la Pêche , ceci pouvant s’expliquer par le fait qu’il est très difficile d’échantillonner ce poisson.
L’observation des cartes d’évolution des populations de Silures
en France nous
montrent que les bassins fluviaux peuvent être rapidement
colonisés, ainsi dans la Loire (de 1980 jusqu'à 1996), depuis
les premiers sujets introduits à Neuvy-Granchamp n’ont mis que quinze
ans pour coloniser l’ensemble du bassin ; ceci a dû être favorisé
par les pêcheurs qui peuvent jouer un rôle important sur la
vitesse d’expansion, en relâchant des individus dans des lieux différents
de ceux de la capture.
La rapidité de l’expansion de l’aire de répartition
du Silure peut également l’expliquer par le fait que les milieux
colonisés lui étaient favorable. Cet aspect sera développé
dans l’étude de ses relations avec les autres poissons.
L’impact du Silure glane dans les eaux où il est plus ou
moins nouvellement présent, est un sujet qui a suscité de
vives réactions de la part de la communauté des pêcheurs
(professionnels et amateurs), ainsi que dans la communauté scientifique
et chez différentes autorités concernées, avec dans
toutes les catégories des pro-silures et des anti-silures.
Nous allons voir qu’il s’agit d’un problème relativement
difficile à résoudre qui comporte de nombreux aspects.
III-1- Les difficultés de l’évaluation
de l’impact
Tout d’abord, ces difficultés viennent du problème
de l’évaluation précise des populations de silures.
En effet l’échantillonnage semble poser des difficultés
avec les moyens traditionnels (pêche électrique), ainsi certaines
campagnes de pêche du Conseil Supérieur de la Pêche
ont montrées que la pêche au filet est beaucoup plus efficace
CEMAGREF-CSP 1987 ), mais ceci entraîne une certaine lourdeur dans
la mise en œuvre, ce qui explique le nombre restreint de données.
De nombreux autres facteurs sont également susceptibles
de modifier les écosystèmes aquatiques ; par exemple la pêche
des amateurs et des professionnels peut influencer significativement les
populations de poissons.
Il y a aussi tous les facteurs physico-chimiques qui peuvent
être modifiés par l’action de l’homme : pollution, rejets
de matières organiques, eutrophisation due aux
engrais drainés dans les zones agricoles, variation artificielle
du niveau des rivières.
Il peut également s’agir de l’explosion démographique
des populations d’autres espèces (écrevisses), ou au contraire
la régression de certaines populations notamment celle du Brochet.
En effet les écrevisses dites américaines (Orconectes
limosus, Pacifastacus leniusculus et Procambarus clarkii) qui colonisent
les eaux européennes ont un développement important, allant
jusqu’à tenir en échec les populations autochtones plus fragiles.
Le brochet est au contraire en nette régression, il est
même classe parmi les espèces menacées en France dans
le livre rouge des espèces menacées en France.
III-2- Les différents impacts
potentiels du Silure
Nous allons tout d’abord traiter chaque aspect de façon
théorique, puis confronter ces hypothèses aux observations
pour conclure sur l’influence du Silure : démontrée,
nulle ou non vérifiable.
III-2-1- La compétition avec les autres prédateurs ichtyophages
La compétition selon la théorie de la niche écologique
correspond à l’utilisation d’une même ressource par une espèce
différente.
D’après Hutchinson (1967), la niche écologique
peut être définie comme un hyper-volume à N dimensions,
où chaque dimension représente une des caractéristiques
de la niche globale (niche trophique, spatiale, temporelle …).
Dans le cas du Silure nous allons regarder les différentes
composantes de la niche qu’il occupe, et les comparer avec celles des autres
prédateurs ; le Brochet (Esox lucius) et le Sandre (Lucioperca lucioperca).
Tableau III : récapitulatif des principales composantes
de la niche écologique du Silure (petit et grand ) ,
du Brochet et du Sandre. (élaboré à partir
de Pinter 1976 …)
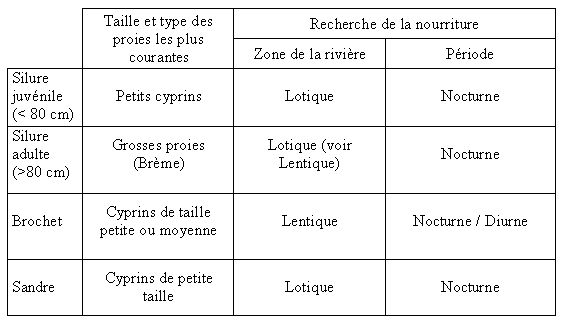
Comme le montrent les données du tableau III les silures
adultes consomment des proies différentes des autres prédateurs,
la niche alimentaire des Silures adultes recouvre peu celles des autres
poissons piscivores. La niche alimentaire du Silure était jusque
là restée vacante, ceci est un des éléments
qui permettent d’expliquer la réussite du Silure dans notre pays.
Les choses ne sont pas aussi claires pour les silures juvéniles,
en effet il semble qu’ils utilisent sensiblement les même ressources
alimentaires que le Sandre voir le Brochet.
De plus, surtout pour le Sandre, les lieux et les périodes
de recherche de nourriture sont sensiblement les mêmes.
Il est donc possible de penser que les silures juvéniles
et les sandres sont susceptibles d’entrer en compétition ; pour
cela il faudrait que la ressource soit limitante, ce qui semble peut probable
dans nos rivières, très riches en poissons fourrages possédant
une forte fertilité.
C’est surtout au niveau de la gène dans la recherche des
proies, et de l’occupation de l’espace que la compétition a le plus
de chance d’avoir lieu.
Il est évident que ce genre de compétition est
difficile à mettre en évidence, et nécessiterait des
expériences particulières qui n’ont pas été
réalisées pour le moment.
De plus, il est intéressant de signaler que la compétition
est un argument souvent avancé mais rarement démontré.
Les relevés piscicoles réalisés notamment
sur la Seille (cf. Annexe) montrent des populations de poissons équilibrées,
avec des proportions de sandres et de brochets ne semblant pas déficitaires.
Cependant, le cas de la Seille ici présenté n’est
peut être pas généralisable à l’ensemble des
bassins fluviaux.
Ces données ne permettent pas de conclure avec précision,
bien qu’il semble peu probable que les silures adultes soient en compétition
directe avec les autres carnassiers, mais pour les silures juvéniles
le problème reste posé.
Il est important de signaler que les relations entre les silures
adultes et les autres carnassier peuvent être d’autre type, notamment
prédateur/proie ; en effet les grands silures ont la possibilité
de consommer d’autres carnassiers comme le montre les analyses de contenus
stomacaux ( PINTER, 1976 ) ; surtout des sandres qui occupent sensiblement
les mêmes parties de la rivière.
III-2-2- Influence sur les populations de proies
Comme cela fut défini par Menge et Sutherland (1976), tous
les niveaux des réseaux trophiques, sauf le dernier, sont potentiellement
limités par des prédateurs.
De plus Menge et Sutherland accordent une importance particulière
aux espèces omnivores, c’est le cas du Silure.
Cela donne au Silure une potentialité de contrôle
descendant de type ‘top down’ très importante, et ceci à
de nombreux niveaux dans les réseaux trophiques aquatiques.
Le Silure peut donc agir à tous les niveaux, suivant sa
taille, depuis la microfaune benthique jusqu’aux gros cyprinidés.
Nous allons nous intéresser plus particulièrement
aux poissons proies, car comme le montre l’étude du régime
alimentaire, lorsque le Silure atteint une taille suffisante (environ 50
cm), il devient essentiellement ichtyophage, bien qu’ayant une large gamme
de proies.
C’est donc sur les espèces de poissons proies que la pression
de prédation sera maximum (Gardon, Brème …) par rapport aux
autres proies potentielles.
Pour résoudre cette problématique, il est possible
de se référer aux campagnes de pêche dans les zones
où le Silure est présent depuis longtemps (« le Silure
glane dans la Seille », 1987,CEMAGREF-CSP) voir Annexe.
Il est également possible de se référer
aux réseaux fluviaux où le Silure y est autochtone, comme
par exemple le Danube.
L’étude des campagnes de pêches nous montrent des
populations équilibrées, où les poissons fourrages
sont présents en quantité importante par rapport aux populations
de carnassiers.
Les données sur les pêches professionnelles aux
engins nous montrent que dans le bassin Rhodanien, les cyprinidés
et les poissons de fond ne sont pas en déficit :
En 1994 il y avait :

(statistique générale 1988-1994 obtenue à partir des carnets de pêches volontaires sur la pêche aux engins dans le bassin Rhône-Saône, DIREN Rhône Alpes).
Contrairement à la théorie de Fretwell ( 1987 )
et Oksanen et al. (1981), qui dit que le niveau supérieur des réseaux
trophiques est limité par les ressources, il semblerait que le Silure
ne le soit pas, même dans les zones où il est présent
depuis longtemps.
Ceci pourrait s’expliquer par le fait qu’il subisse une pression
de pêche relativement importante, limitant les populations de silures
à des niveaux ne permettant pas la surexploitation des ressources.
Cette remarque semble valable pour tous les poissons ichtyophages
des eaux françaises.
Il est intéressant de remarquer que les populations de
silures, des zones les plus anciennement colonisées, semblent être
à l’équilibre (« Point sur le Silure en France »,
CSP 1995).
la structures de peuplement dans les plus vieilles populations
de Silures françaises (Saône, Seille) est très semblable
à celle des pays de l’Europe de l’est d’où le Silure est
originaire, cette constatation est en accord avec la théorie
selon laquelle le Silure est adapté à certaines partie
de notre réseau hydrographique.
Un autre facteur de régulation, est la pression de pêche
exercée sur ce poisson, ce facteur va dans le sens d’un maintien
de l’équilibre.
La conclusion sur les éventuels déséquilibres
provoqués par le Silure sur les populations de proies est qu’il
ne semble pas agir de façon significative sur ces populations, ceci
étant peut être dû à la pression de pêche
effectuée sur ce poisson.
Les catastrophes écologiques annoncées par certains
peuvent être raisonnablement écartées, au moins dans
la mesure où la pression de pêche sur ce poisson persiste
III-2-3- Maintien de la diversité par la prédation
C’est un argument plutôt positif qui n’a jamais été
évoqué ; il est basé sur les observations de Pain
(1966) où, sans prédateurs (étoile de mer : Pisaster
sp.), la faune des rochers littoraux est dominée par une seule espèce
(Mytilus) ; la présence du prédateur permet la coexistence
d’un plus grand nombre d’espèces.
Tableau IV : recapitulation des expesiences de Pain(1966)

Cet argument est d’autant plus intéressant que la plupart des
eaux françaises sont eutrophisées, provoquant souvent une
grande croissance des populations de cyprinidés, avec la dominance
d’un petit nombre d’espèces ( gardon, brème), probablement
au détriment des espèces de cyprins moins importantes qui
sont
souvent plus sensibles aux pollutions. La prédation de ces espèces
pourrait donc être un facteur dans la structuration des communautés
de proies.
Il n’y a pas de conclusion possible pour cet argument, car aucune
étude précise n’a été menée a ce jour
dans cette optique.
III-2-4- Importation de nouveaux parasites
Ce problème s’est déjà posé lors de
la colonisation du Sandre, qui est un hôte du cycle de la Bucéphalose.
Comme tous les poissons, le Silure est susceptible de subir l’action
de
pathogènes (viroses, bactérioses, mycoses, parasitoses),
on peut noter particulièrement le protozoaire de l’Ichtyophtiriose
qui a décimé une grande partie des silures des piscicultures
de la région centre en 1994 ( Aquarevue n°58 Septembre 1995
) ;ce parasite qui s’attaque à la plupart des poissons d’eau douce,
est sans doute le plus courant des ectoparasites des poissons d’eau douce,
à travers le monde entier.
Ce parasite qui est un protozoaire cilié, ne connaît
pas de résistances naturelles (Ventura et Paperna 1984).
Il n’y a pas de parasites connu susceptible d’être véhiculé
spécifiquement par le Silure.
IV-1- Impacts économiques
Les interactions entre les populations de silures et l’économie sont multiples, nous allons distinguer deux grands types d’interactions, celle qui sont relatives aux populations naturelle de silure, et celle qui sont reliée aux activités de pisciculture.
IV-1- 1- Impact induit par les populations naturelles de silures
Les relations entre les populations naturelles de silures et l’économie se font essentiellement par le biais de la pêche amateur et professionnelle.
La pêche professionnelle du Silure reste modeste, comme
le montre les statistiques générales sur la pêche aux
engins dans le bassin Rhône-Saône (obtenues à partir
des carnets de pêches volontaires 1988-1994) (figure 8), en 1994
en Saône aval il s’est presque capturé 9 tonnes de silure,
et autant sur le Rhône aval ; cela concerne un nombre restreint de
personnes, mais doit jouer un rôle ,non négligeable dans la
prise de connaissance de ce poisson par le publique, à l’aide de
sa commercialisation et de sa restauration.
Cette prise de connaissance va probablement influer de façon
importante sur les activités de pisciculture de ce poisson.
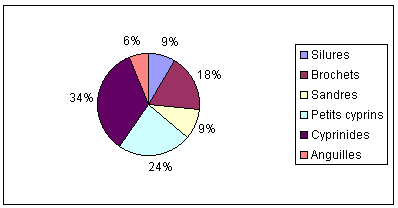
Figure 8 : Résultat de la pêche professionnelle
en 1994 sur la Saône aval, établis a partir des carnets de
pêche volontaire
(La pêche aux engins dans le bassin Saône Rhône,
DIREN Rhône Alpes 1996)
La figure 8 nous montre également que par rapport aux cyprinidés
les quantités de silures pêchées sont six fois moins
importantes mais que par rapport au brochet et à l’anguille
elles ne sont pas négligeables.
Cette nouvelle ressource pour les pêcheurs aux engins peut
représenter un supplément économique non négligeable,
d’autant que la qualité de la chaire du silure est bien supérieure
à celle des cyiprinidés.
La pêche amateur peut avoir des répercussions beaucoup
plus importantes, elles peuvent être multiples, cela va du détaillant
d’articles de pêche jusqu’au secteur hôtelier, comme cela a
pu se développer en Espagne sur les rives du Rio Ebro.
Il n’y a pas de chiffre précis sur l’impact du Silure
sur ces différentes activités professionnelles, cependant
toutes les personnes rencontrées sur le terrain signalent que la
présence du Silure, dans les eaux publiques, est un point positif
au niveau commercial.
Comme en Espagne, où le tourisme pêche s’est
développé, ce poisson qui est le plus gros de nos rivières
suscite des réactions passionnées de la part des pêcheurs
à la ligne.
C’est ce point qui explique les retombées économiques
et le tourisme vert qui se met en place autour de ces nouvelles activités
le silure peut représenter un atout touristique indéniable
(Cortay 1997).
IV-1- 2- Activités associées à la piscicultures :
L’autre grande partie des retombées économiques
provoquées par le Silure sont celles dues à la pisciculture
de ce poisson.
Comme nous l’avons vu, elles sont en partie liées aux
populations naturelles, car le fait que le poisson soit connu du public
est un point important pour sa commercialisation.
Au niveau technique, les reproductions naturelles semi-contrôlées
et artificielles sont parfaitement maîtrisées (Vallod 1987
et Aquarevue n°52 février-mars 1994).
Les limitations se font au niveau de la commercialisation, ces
problèmes viennent principalement de l’a priori du public, cela
explique la démarche de
l’ADARC pour valoriser ce poisson, en le renommant ‘merval’ (Aquarevue
n°52 février-mars 1994).
C’est cependant un poisson qui suscite l’intérêt
des pisciculteurs comme le montrent les différentes études
de faisabilité. Dés 1984, EDF propose une analyse financière
prévisionnelle d’une unité industrielle d’aquaculture intensive
produisant 400 tonnes par an de silure. Puis des études complémentaires
sur le transport vivant du Silure glane et les possibilités de commercialisation
en Languedoc Roussillon, ont été effectuées en 1989
par l’ISARA et le CEMAGREF.
Cet engouement pour le Silure s’est propagé dans toute
la France comme le montre l’étude de faisabilité de l’élevage
du Silure dans les pays de Loire, de JP Gérard en 1991.
Ces études ne concernent pas seulement le milieu de la
production aquacole, mais également celui de la commercialisation,
avec par exemple l’étude de DEFIX en 1994 sur la viabilité
d’une commercialisation en direct de poisson d’eau douce, la Carpe et le
Silure aux restaurateurs lyonnais.
En effet le Silure présente des rendement intéressant,
par exemple le ratio kilo de Proie par rapport au kilo de poisson formé
est faible : pour le Silure <2, pour le Sandre >2 et pour le Brochet
environ 3,5.
La chair du Silure est également un argument de choix,
comme le montre l’étude sur la qualité des poissons d’étangs
(Pisciculture française n°121 , 3eme semestre 1995.
Les examens physico-chimiques et rhéologiques montrent
que la chair du Silure glane est intéressante pour la consommation,
d’autant plus que sa durée de stockage peut être estimée
à une vingtaine de jours ( Mantley et al. 1987 ), et comme matière
première industrielle. La teneur en matière grasse du Silure,
le classe dans le catégorie des poissons dits semi-gras, le ratio
acide gras insaturé sur saturé ne le distingue pas beaucoup
des autres poissons (truite, carpe, cabillaud). Sa valeur calorifique le
positionne dans la moyenne des poissons d’eau douce.
L’examen sensoriel montre que la chair du Silure ne contient pas d’arêtes, elle est considérée comme de qualité, et permet de multiples transformations ( Mantley et al. 1985), avec par exemples : fillets, fillets fumes, darnes de poisson, escalope…(Aquarevue 1994 No 52) .
Des possibilités intéressantes sont présentées
par l’utilisation de sources géothermiques dans le but d’augmenter
le rendement de la production ; comme cela a été mis en place
aux viviers de la Castillonne par Ribes qui a réussi la production
de silure triploïdes présentant l’avantage d’une croissance
rapide, d’une chair moins grasse et l’impossibilité de se reproduire
( voir IV-B, Aquarevue n°37 1991, Sciences et avenir n°553 1993
).
Pour l’instant la gestion des milieux aquatiques des eaux publiques
ne tient pas compte du Silure.
Seuls des déversements de silures de façon non
contrôlées ont lieux, ceci est possible car le Silure est
classé comme une espèce indigène aux eaux françaises.
Dans ce chapitre, des propositions permettant la mise en place
d’une gestion spécifique du Silure vont être abordées.
Deux grands types de décisions peuvent être prises
: celles qui vont protéger ce poisson, et celles qui vont limiter
son expansion.
Le Silure glane comme beaucoup de poissons subit de fortes pressions de pêche, en Europe de l’est dans certaines régions il est en régression.
Comme dans ces pays et comme pour les autres carnassiers des mesures
peuvent être prises pour sa protection :
- taille minimale de capture
- nombre de prises maximal
- limitation des périodes de pêche
- réserves de pêche, notamment pour les frayères
.
La taille minimale de capture est un problème difficile
à résoudre car pour une gestion rationnelle des ressources
il faudrait ne pas prélever des sujets ne s’étant pas
encore reproduits.
Or, les meilleurs poissons pour la consommation sont les plus
petits, ce qui amène à une contradiction . Une fourchette
de capture semble donc le meilleur compromis, une proposition raisonnable
serai une taille comprise entre 0,5 et 1 mètre, permettant de protéger
le poisson de moins de 2 étés et de ne pas provoquer de prélèvements
excessifs chez les adultes reproducteurs.
Le nombre de prise maximum semble être une mesure facile
à mettre en œuvre et limitant les excès, ce nombre est à
choisir en fonction des effectifs des populations.
La protection des frayères par des zones de réserve et des périodes de non-prélèvement semble relativement important, car les silures sont vulnérables durant cette période.
Les empoissonnements doivent être faits avec mesure, comme cela est conseillé par le conseil supérieur de la pêche, avec éventuellement des poissons triploïdes (« Le point sur le Silure » ,Barbier 1995).
Les mesures visant à limiter l’expansion de ce poisson qui ne sont pas forcement fondées sur des réalités scientifiques, comme nous l’avons vu précédemment .
D’après B.Barbier 1995, il est possible de ne pas remettre
à l’eau les sujets très gros quand on craint de trop fortes
densités ; actuellement la pêche sans astreinte particulière
limite la surpopulation.
De plus, le maintien des populations de silures à des
effectifs non surdensitaires, est possible par un contrôle de type
‘bottom-up’, surtout dans les petites pièces d’eau.
Depuis longtemps, le Silure a suscité des réactions
violentes pouvant aller jusqu’à la peur de la prédation de
l’Homme par le Silure (« Is the giant catfish Silurus glanis a predator
on man ? » Gudger 1945).
Souvent, les peurs furent axées sur les ravages du Silure
sur la faune aquatique, comme nous l’avons vu, ces affirmations ne sont
pas scientifiquement fondées, elles sont probablement dues au régime
alimentaire du Silure qui peut être très varié, ainsi
qu‘a ses potentialités de capture d’animaux comme certains oiseaux
aquatiques, mais surtout à cause de sa taille et de sa morphologie.
Les premières captures de silures dans toutes les régions
où il était nouvellement présent engendrèrent
des réactions des media, avec des articles souvent très expressifs
: « Silure, la mauvaise réputation », « Phénoménal,
un silure de 25 kilos… », « Un silure géant de 2,20
m et 50 kg », « Faut il avoir peur du Silure ?… ».
Même certaines personnalités se sont émues
de l’introduction de ce poisson, ainsi B.Bardot s’est inquiétée
de la présence du Silure.
Bien que ceci reste anecdotique, cela influe sur l’opinion publique,
ces réactions à caractère négatif ne sont sans
doute pas étrangères à l’appréhension exprimée
au niveau culinaire, et pouvant avoir des répercutions économiques.
Aujourd’hui les mentalités sont en train de changer, le
silure est maintenant présent de manière significative depuis
plus de vingt ans dans certaine régions, et les réactions
médiatiques n’ont plus lieux que lors de capture exceptionnelle,
comme cela fut le cas en mai 1998 avec la prise d’un poisson de 2.58 mètres
pesant plus de 100 kilogrammes.
Comme nous venons de le voir, la réintroduction du Silure
glane est un bel exemple de biogéographie, ‘un retour grâce
à l’homme’, dans des régions où il avait disparu depuis
plus de 10 000 ans.
Le fait que le Silure ne soit pas un poisson qui provienne de
milieux très différents de ceux que l’on rencontre en Europe
de l’ouest, est probablement un élément important dans l’explication
de la faiblesse de son impact écologique.
Un autre facteur important dans la réussite de sa colonisation est qu’il occupe une niche écologique vide.
Même si le Silure est susceptible de jouer un rôle
bénéfique dans la structuration des communautés piscicoles,
il convient de rester prudent et de continuer à surveiller ses populations.
En effet la situation actuelle ne pose pas de problèmes,
mais elle n’est pas fixée et les équilibres peuvent être
rompus, de plus nous disposons de peu de données sur cette espèce
et il convient donc de suivre la dynamique des populations de ce poisson.
Au niveau économique, les retombées sont certaines, en effet, ce poisson s’il est bien géré peut représenter une ressource économique non négligeable, avec notamment le tourisme qu’il peut engendrer.
Cependant, le Silure n ‘est pas actuellement pris en compte dans
les plans de gestion de l’ichtyofaune des eaux publiques françaises.
Ceci pourrait être la cause des baisses d’effectifs observées
dans certains secteurs où il semblait bien installé (par
exemple la Seille).
Il serait dommage de ne pas réussir la valorisation de
notre réseau fluviale grâce à ce poisson.
Cette étude reflète l’évolution et les contraintes
que les biocénoses aquatiques subissent de nos jours.
Cette évolution et en grande partie due aux l’actions
de l’homme, avec la dégradation du milieu et son intervention dans
l’introduction des espèces.
Les enjeux actuels ne sont plus seulement basés sur la
production de nourriture, mais également sur le rôle important
que peuvent jouer les milieux aquatiques au niveau touristiques.
ABDULLAYEV M.A.,KHAKBERDIEV B.,URCHINOV D.,1978.-Biologiy of the catfihs Silurus glanis from some lakes in the lower Zarafshan River and in the Khorezm district. J. Ichthyol., 17(3) : 487-491.
ALLARDI J., KEITH P., 1991. –Atlas preliminaire des poissons d’eau douce de France. Museum National d’Histoire Naturelle, CSP, CEMAGREF, Ministere de l’environnement.
ALLARDI J., LAINEZ B., 1986. -Sur l’extention recente du silure glane (Silurus glanis) en France.
AQUA REVUE 1994. – « le mervale, j’en veux ». Aqua revue no 52.
AQUA REVUE 1995. – Fiche sur le panorama des especes aquacoles : le silure. Aqua revue n 11 : 17-18.
AQUA REVUE 1995. – Parasitisme : le silure glane touche en re gion centre. Aqua revue n 58 : p 44
AQUA REVUE 1995. –Le silure depassera les 500 tonnes en 1995. Aqua revue n 60 : p 18.
AQUA REVUE 1996. – Reproduction artificielle de silure : une operation de specialiste. Aquq revue n 159 : p 28.
BARBIER B., 1995. –Le point sur le silure en France… Note presentee aux conseil d’administration du CSP.
BERG L.S., 1964.- Freshwater fishes of the USSR and adjacent countries.Vol. 2. 4e ed. : 469-475.
BERTIN, 1942. –Petit atlas des poissons.
BERTIN, 1949. –La vie des animaux. Tome I :370.
BRANA J.Y., RIGAUD G., 1997. –Influence de l’homme sur l’expansion du silure en Europe.
CEMAGREF., CSP., 1987. –Le silure glane dans la Seille. Compte rendue de 4 campagne de peches.
CLOUX T., DUCHESNE P., FROMENTIN P., 1996. –Silure la Loire pour d’autres perspectives. Fun pêche n 15, 82-86.
CORTAY, G., 1997. –Le silure un atout pour demain. Le pêcheur de France no 40 p 70-71.
DE BOISSET L., 1947. –Poissons des rivières de France.
DE LA BLANCHIERE, 1868. –La pêche et les poissons. Dictionnaire générale des pêches.
DEPERRET C., 1885. –Description des vertébrés du pliocène d’eau douce du Roussillon. Thèse Paris G.MASSON.
FRETWELL., 1987. – Food chain dynamics : the central theory of écologie. Oikos 1987 p291.
GALIAY E., 1997. –Bilan des passages de silure aux stations de contrôle du bassin Garone-Dordogne. CEMAGREF, CSP, INP ENSEEIHT.
GERARD J.P., 1991. –Etude de la faisabilité de l’élevage du silure dans les pays de la Loire. Ecole nationale vétérinaire de Nantes, service d’aquaculture et pathologie aquacole.
GODARD. B., 1996. – Des silures à la ferme. Le pêcheur de France n 159 : p 28.
GUDGER., 19445. « Is the giant catfish Silurus glanis a predator on man ? » .
HORVATH L., 1977. –Improvement of the method for propagation, larval and post-larval rearing of the Wels (Silurus glanis). Aquaculture 10(2) : 161-167.
HORVATH L.,LUKOWIICZ M., 1982. –Tables with data of Hachery procedures and rearing process of some bred warmwater fishes. Aquacult. Hung., vol.3 :212-219
HORVATH L., TAMAS G., TOLG I., 1984. –Special methodes in pond fish husbandry, John E. Halver Ed., 150p.
MALYUKINA G.A., MARTEM’YANOV V.I., 1982. –An electrocardiographic study of chemical sensitivity in some freshwatre fishes. J Ichthyol., 21(3) : 77-84.
MARTIN. J.F., POLI. J.M., PETlLLOT. F., 1995. La qualité Des poissons d’étang. La pisciculture française n 121, 3e trimestre.
MENGE., SUTHERLAND., 1976. –Species diversity gradients : synthesis
of the rôle of predation, compétition and temporal heterogeneity.
The american naturalist
Vol 110, No 973 p 339-349.
MOHR E., 1957. –Der Wels. Wittemberg Lutherstadt.
ORLOVA E.L., POPOVA A., 1976. –The feeding of predatory fish, the sheatfish, Silurus glanisand the pike, Esox lucius, in the Volga delta Following régulation of the discharge of the river. J. Ichthiol., 16(1) : 75-87.
OKSANEN., 1981. – Exploitation écosystèms in gradient of primary productivity. The american naturalist Vol 118, No 2 p 240-261.
PERRIN J.F., GOUISSET., 1996. –La peche aux engins dans le bassin Rhon Saone, statistiques generales 1988-1994 obtenues à partir des carnetss de peche volontaires. DIREN Rhone Alpes.
PLANCHE B., 1987. Biogéographie, biologie et élevage du silure. DEA rapport bibliographique.
ROULE L., 1925. –Les poissons des eaux douces de la France. Press. Univ. De France. 228p.
ROULE L., 1935. –Les poissons et le monde vivant des eaux. Tome VIII : Les poissons des eaux douces : 58-59.
SHIKHSHABEKOV M.M., 1979. –The sexual cycles of the catfish Silurus glanis , the pike,Esox lucius, th perch perca fluviatilis, and the pike-perch, Lucioperca lucioperca.J. Ichtyol., 18(3) :457-468.
SPILLMAN Ch.J., 1961. –Faune de France.65 poissons d’eau douce.Paul Lechevalier (Paris) Ed., 303p :166-168
STOLIAROV I.A., 1985. –Dietary Feathures of sheatfish, Silurus glanis, and pike-perch , Stizostedion lucioperca, in Kislyarsk Bay, Northern Caspiena sea. Vopr. Ikhtiol., n 1 : 160-164.
THEOUOV R.T., GOUSEVA L.N., 1977. –Biologie of juvenile wels in the lower course of the Amyl river. Modern state of natural Ressourses CCP : 61-69.
TOTH E.O., SZABO G., OLAH J., 1980 –Moist feed preference of the sheatfish.Aquqcult. Hung., 2 : 37-43.
VALLOD D., 1987. –Le silure. Publication de l’association pour le developpement
de l’aquaculture.
Tableau des résultats, exprimés en effectif et en biomasse des pêches électriques et au trémail réunies pour les 4 campagnes sur la Seille 1986-1987

